西安医学院第二附属医院始建于1937年,医院“三迁院址,八易其名”,是一所集医疗、教学、科研、预防、保健、康复为一体的三级甲等综合医院。医院现占地面积59789.6平方米,医疗用房面积56349平方米,编制床位800张,实际开放床位1170张,现有在职职工1800余名,卫生专业技术人员1515人,其中高级职称233人、硕博士337人。
医院设置临床医技科室50个;成立了“心脑血管病院”“妇幼医院”“美容整形医院”和“眼视光诊疗中心”;获批国家标准版胸痛中心示范中心、国家脑防委综合防治卒中中心、国家眼部疾病临床医学研究中心光明中心、第一批国家分娩镇痛试点医院、国家第一批消化系统肿瘤MDT试点医院、国家PCCM科规范化建设达标单位、西安市重点实验室“西安市眼-脑神经相关疾病防治重点实验室”、西安市国际科技合作基地“西安市眼科学与视觉科学国际科技合作基地”等。在科研成果方面,近年来我院获批国家自然科学基金面上项目、青年项目、陕西省重点产业链项目、陕西省杰出青年科学基金项目等各级各类科研项目94项,发表论文共计427篇,其中SCI论文87篇,获批专利98项,先后获批省级重点专科5个,陕西省临床医学研究分中心2个。
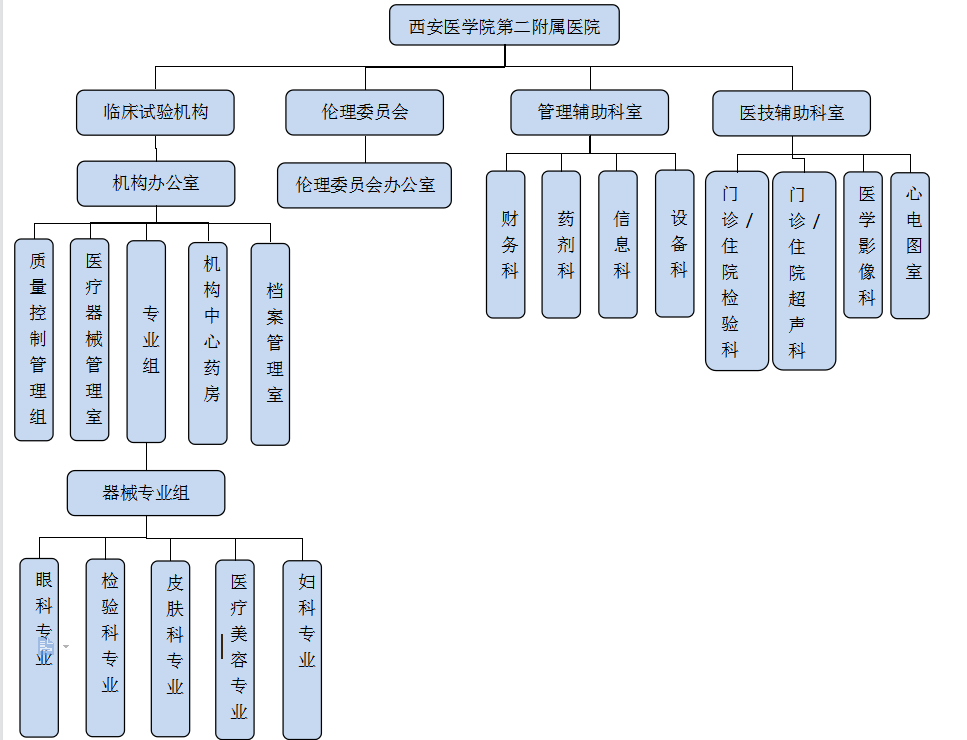
2022年医院开始筹建临床试验机构,成立药物/医疗器械临床试验机构办公室。临床试验机构依托医院强大的实力,根据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》、《药物临床试验质量管理规范》(2020版)和《医疗器械临床试验质量管理规范》(2022版)等相关法律法规开展工作,是医院开展药物/医疗器械临床试验的主要平台。
西安医学院第二附属医院药品/医疗器械临床试验组织管理机构接受国家药品监督管理局、省药品监督管理局和医院的多重管理与监督。2023年5月26日通过NMPA医疗器械临床试验机构备案管理信息平台完成备案,备案号“械临机构备202300068”;医疗器械备案专业有眼科、检验科、皮肤科、医疗美容科、妇科5个专业组,可进行II类、III类医疗器械的临床试验。机构主要负责对各专业的医疗器械临床试验进行统一管理、监督和指导,以保证临床试验严格按药物/医疗器械临床试验质量管理规范(GCP)规范执行。
药品/医疗器械临床试验机构下设机构办公室,负责机构日常工作。机构设有办公室主任1人、办公室副主任2人、质控员5人、资料管理员2人、药品/医疗器械管理员2人、机构秘书1人,全权受理与管理在我院进行的药物/医疗器械临床试验,保证临床试验过程规范、结果科学可靠、有效保护受试者的权益。
机构定期组织本院职工参加GCP培训,同时选派参与临床试验的主要研究人员参加院外的GCP培训,使其拥有一批临床试验经验丰富的临床研究人员和管理人员。机构与主要研究者PI(PI-Principle Investigator)一起承担药品/医疗器械临床试验。
机构根据GCP原则建立了较完备的管理文件、制度、SOP和急救流程,并督促各临床专业构建了完善的医疗器械临床试验专业组制度及SOP。医院临床专业科室相关人员参加了省级医疗器械临床试验质量管理规范培训。我们将认真贯彻《世界医学大会赫尔辛基宣言》、《药物临床试验质量管理规范》及《医疗器械临床试验质量管理规范》等,为我省乃至全国的药物及医疗器械临床试验做出应有的贡献。
临床试验机构办公室 电话:029-83548721
申请资料投递邮箱:1074139117@qq.com





